ГЛАВНАЯ >>>СПРАВОЧНИК ПО ХИРУРГИИ
Глава 10
ТРАНСПЛАНТОЛОГИЯ
ИММУНОБИОЛОГИЯ АЛЛОТРАНСПЛАНТАТА
ПРЕДОТВРАЩЕНИЕ ОТТОРЖЕНИЯ
ТРАНСПЛАНТАТА
ПЕРЕСАДКА КОСТНОГО МОЗГА
ПЕРЕСАДКА ОРГАНОВ
МЕТОДЫ СОХРАНЕНИЯ
ОРГАНОВ ДЛЯ ТРАНСПЛАНТАЦИИ
Человеческий организм обычно не умирает
внезапно, как взорвавшийся воздушный шарик, — орган за органом постепенно
теряют свои функции. Клинические методы пересадки органов разрабатываются
для замещения органов, функция которых оказывается необратимо утраченной.
Поскольку на пути приживления в организме генетически чужеродной ткани
стоит иммунологический барьер, что проявляется в реакции отторжения трансплантата,
иммунологи и хирурги работают совместно со времен Второй мировой войны
над поиском решения этой проблемы.
Трансплантация целых органов или даже клеточных
взвесей для лечения финальной стадии недостаточности органов, генетических
и метаболических заболеваний — одно из величайших достижений иммунобиологии
и хирургии этого века. После описания техники сосудистых анастомозов пересадка
васкуляризированных органов стала технически возможной. Реакция отторжения,
развивающаяся против всех трансплантатов, за исключением трансплантатов,
полученных от однояйцевых близнецов, ведет к пониманию того, что у каждого
индивидуума имеются врожденные индивидуальные антйгенные различия по гистосовместимости.
Иммунобиология
аллотрансплантата
В целом чем значительнее генетические отличия
между трансплантатом и реципиентом, тем выраженнее реакция отторжения.
Выраженность этой реакции при пересадке тканей или органов у индивидуумов
одного и того же биологического вида (аллотрансплантаты, или гомотрансплан-таты)
пропорциональна степени генетического различия между ними. При пересадке
трансплантатов от особей другого вида (ксенотрансплан-таты, или гетеротрансплантаты)
реакция отторжения развивается еще быстрее. Трансплантаты от однояйцевых
близнецов (изотрансплантаты, изогенные, или сингенные, трансплантаты) или
трансплантаты, пересаживаемые внутри одного и того же организма, приживаются
без осложнений после восстановления их нормального кровоснабжения.
ТРАНСПЛАНТАЦИОННЫЕ АНТИГЕНЫ (АНТИГЕНЫ
ГИСТОСОВМЕСТИМОСТИ)
Реакция отторжения трансплантата вызывается
чужеродными антигенами гистосовместимости на поверхности клеток трансплантата.
Точно также ксенотрансплантаты других биологических видов быстро отторгаются,
поскольку тканевая несовместимость между большинством биологических видов
настолько глубока, что в сыворотке хозяина еще до трансплантации могут
циркулировать соответствующие4нтйтела. Аллоантигенная несовместимость между
особями одного вида вариабельна, однако и сильные антигены могут вести
к отторжению трансплантата через 8 дней, тогда как более слабые различия
позволяют трансплантату выживать на протяжении более 100 дней.
Гены основного комплекса гистосовместимости
(ОКГ) подразделяются на три класса: класс I, класс II, класс III. Только
молекулы I и Ц классов играют существенную роль при трансплантации. Хотя
детерминанты класса I и класса II некогда рассматривались как антигены,
теперь известно, что они играют ключевую роль в активации Т- и В-лимфоцитов
в дополнение к обеспечению распознавания гистосовместимости. Молекулы класса
I человеческого лейкоцитарного антигена (HLA) могут быть обнаружены на
поверхности почти всех содержащих ядра клеток. Напротив, молекулы класса
II HLA обнаруживаются только на поверхности клеток иммунной системы — макрофагов,
дендритических клеток, В-лимфоцитов и активированных Т-лимфоцитов. Тяжелые
цепи класса I (37-45 кДа) в значительной мере полиморфны и нековалентно
связаны на поверхности клеток с легкой цепью В2-микроглобулина
(В2М), которая удивительно устойчива. В генах класса И, известных
также как гены иммунного ответа, закодирован генетический материал для
иммунного ответа. Они обеспечивают иммунный ответ на многие антигены. В
них также закодировано некоторое количество антигенов, экспрессируемых
лимфоцитами. Локусы класса II у людей включают HLA DR, DQ, DP. Экспрессия
антигенов класса II в норме присутствует в клетках, происходящих из стволовой
клетки костного мозга.
ПОДБОР ПО ГИСТОСОВМЕСТИМОСТИ
Для демонстрации антигенного сходства тканей
донора и реципиента перед трансплантацией были разработаны различные методы,
чтобы можно было подобрать относительно гистосовместимые пары — донора
и реципиента. Наилучший из современных методов называется серологическим,
или лейкоцитарным, типированием. Антигены системы HLA, экс-прессируемые
циркулирующими лимфоцитами, могут быть определены с помощью сывороток,
полученных от пациентов, перенесших множественные гемотрансфузии, или от
женщин, имевших множественные беременности. Используя лейкоциты пациента
и ряд стандартных сывороток, можно охарактеризовать большинство сильных
антигенов как у донора, так и у реципиента.
Несколько моментов, касающихся подбора
по гистосовместимости, заслуживают особого внимания.
1. У реципиентов, которым производится
пересадка даже от доноров, идентичных с ними по HLA, будет развиваться
отторжение трансплантата, пока не будут применены иммуноеупресеивные препараты.
Только однояйцевый близнец является идеальным донором. ; . «
2. Даже при плохом подборе гистосовместимости
доноров Из числа родственников реципиента результаты часто оказываются
хорошими.
3. Даже при хорошем подборе по гистосовместимости
трансплантат не приживется, если в организме реципиента уже .имеются антитела
против ткани донора, согласно цитотоксическому тесту.
4. Наличие АВО-изогемагглютИнйнов приведет
к быстрому отторжению большинства пересаживаемых органов, несущих несовместимые
по группе крови субстанции.
5. Тканевое типирование трупных тканей
лиц, не являвшихся родственниками реципиента, не бывает успешным.
ИММУННЫЙ АППАРАТ
При рождении человеческий организм уже
иммунокомпетентен и подверга-етвр процессу комплексного развития. В настоящее
время принято считать, что существует единственная полипотентная кроветворная
стволовая клетка, обнаруженная в экстраэмбриональном желточном мешке. Дочерние
стволовые клетки мигрируют в различные органы для дальнейшей диффе-ренцировки.
Онтогенез иммунного ответа. Первыми
незрелыми клеточными линиями, которые должны быть созданы, являются лимфоидная
и миелоидная. Лимфоидные клетки-предшественники мигрируют в вилочковую
железу (Т-клетки) или в эквивалент сумки Фабрициуса (В-клетки), чтобы дифференцироваться
в зрелые Т- и В-лимфоциты. Два основных типа лимфоидных клеток — В- и Т-лимфоциты
— играют главную роль в отторжении трансплантата. В-лимфоциты обеспечивают
гуморальный ответ, или ответ антител на антиген, тогда как Т-лимфоциты
ответственны за связанные с клетками функции иммунной системы. Существует
два основных вида Т-лимфоцитов. CD8+ зрелые Т-лимфоциты способствуют функциям
клеток-эффекторов, таким как прямая цитотрксическая атака для отторжения
трансплантата, тогда как CD4+ Т-лимфоциты играют роль иммунорегуляторов
(хелперов) посредством секреции цитокинов, которые оказывают паракринный
эффект, направленный на активацию или подавление чуть ли не всех механизмов
иммунного ответа.
Т-лимфоциты представляют собой популяцию
иммунокомпетентных клеток, ответственных, скорее, за клеточный, нежели
гуморальный иммунитет. Ответы со стороны Т-лимфоцитов включают реакции
гиперчувствительности замедленного типа, антивирусную активность и многие
из ранних реакций, участвующих в отторжении трансплантата.
В-лимфоциты развиваются из стволовых клеток
костного мозга и становится ответственными за выработку циркулирующих Иммуноглобулинов
и тем самым — за гуморальный иммунитет.
Лимфоциты — это клетки, специфически
реагирующие при отторжении трансплантата. Клетки-предшественники Т-лимфоцитов
возникают из полипотентной костномозговой стволовой клетки через образование
ряда промежуточных форм. Эти клетки затем мигрируют в вилочковую железу
и созревают там, претерпевая ряд генетически детерминированных изменений,
что приводит к приобретению ими специфических мембранных рецепторов.
CD-антигены определяют функцию Т-лимфоцитов:
СД8+ цитотоксичная/ супрессорная группа лизирует клетки-мишени и уничтожает
клетки, инфицированные вирусом, а СД4+ Т-лимфоциты функционируют как иммунорегуляторные
клетки (хелперы/индукторы), посредническая роль которых заключается в организации
взаимодействия Т-лимфоцитов, В-лимфоцитов, макрофагов и других клеток за
счет выделения цитокинов.
Обобщенное представление о реакции отторжения
пересаженного органа. После пересадки органа развивается типовая цепь
событий. Первым определяемым изменением является появление периваскулярных
круг-локлеточных инфильтратов. Накапливается комплекс клеток: видны клетки,
напоминающие малые лимфоциты, так же как и крупные трансформированные лимфоциты.
Сюда же начинают поступать в значительных количествах и крупные гистиоциты,
или макрофаги.
Антитела и комплемент накапливаются в области
капилляров и некоторые из лимфоидных клеток инфильтрата продуцируют к 3-му
дню антитела.
Сенсибилизированные лимфоидные клетки при
распознавании чужеродной ткани выделяют различные медиаторы воспаления
и клеточного повреждения. Выделяемые цитотоксичные вещества непосредственно
повреждают мембраны близлежащих клеток. Митогенные продукты стимулируют
деление лимфоидных клеток, тем самым, вероятно, увеличивая популяцию иммунокомпетентных
клеток. Активированные фагоцитирующие макрофаги концентрируются в этой
зоне благодаря фактору угнетения миграции, другим хемотаксическим факторам
и цитокинам, выделяемым активированными клетками. Помимо этого, выделяются
вещества, повышающие проницаемость сосудов.
Тем временем здесь фиксируется комплемент,
благодаря чему происходит выделение хематтрактантов, анафилатоксинов и
в конце концов, когда активируются конечные фракции каскада комплемента,
происходит повреждение клеток. За счет анафилатоксинов, представляющих
фракции каскада комплемента, и, вероятно, за счет кининов повышается проницаемость
капилляров. Становится выраженным интерстициальный отек. В то же время
на инфильтрат воздействуют различные дополнительные факторы. В составе
каскада комплемента генерируются фракции, имеющие адгезивные и хематтрактантные
свойства. Поврежденные клетки продуцируют дополнительно вещества, которые
способствуют инфильтрации ткани полиморфно-ядерными лейкоцитами (ПМЯЛ),
так же как и другими клетками. ПМЯЛ в свою очередь выделяют вазоактивные
амины (включая гистамин или серотонин — в зависимости от биологического
вида) и дополнительные факторы, повышающие проницаемость сосудов. ПМЯЛ
проникают через расширенные межэндотелиальные щели капилляров и выделяют
протеолитические вещества — катеп-сины D и Е, вызывающие повреждение базальных
мембран.
К 7-му дню откладываются фибрин и а-макроглобулины,
значение которых в реакции отторжения трансплантата непонятно. В это время
лимфоидные клетки продолжают накапливаться и вместе с плазматическими клетками
и ПМЯЛ меняют картину нормальной структуры ткани трансплантата. В этом
месте в составе инфильтрата предположительно содержится много макрофа-гов
и других иммунологически неспецифичных клеток. Повышенное количество митозов
в инфильтрате может указывать на пролиферацию иммуно-компетентных клеток
в трансплантате.
Мелкие сосуды оказываются закупоренными
фибрином и тромбоцитами, что ухудшает перфузию трансплантата и его функцию.
В этой относительно быстро развивающейся цепи событий пересаженный орган
имеет небольшой шанс на ответную реакцию, и патологический процесс доминирует
за счет реакции организма реципиента.
Повреждение эндотелиоцитов также вызывает
процесс, называемый по традиции ускоренным атеросклерозом. Тромбоцитарные
агрегаты в верхнем слое рассасываются, и лизис тромбов сопровождается инфильтрацией
стенки сосудов макрофагами и пенистыми клетками. В результате» отмечается
утолщение интимального слоя с потерей гладкой эндо-телиальной выстилки
и наличием вакуолизированных клеток.
Хотя повреждение эндотелиоцитов и отчетливая
пролиферации глад-комышечных клеток свидетельствуют в пользу того, что
они являются важными клетками-мишенями в иммунной реакции, имеются доказательства,
что основной иммунный удар принимают на себя базальные и эластические мембраны
сосудов.
В возникновении повреждения тромбоциты
могут играть большую роль, чем ПМЯЛ. Иммунные комплексы (которые активируют
комплемент) приводят к адгезии тромбоцитов и выделению ими вазоактивных
веществ. Агрегация тромбоцитов сопровождается выделением гистамина, серотонина
и других факторов повышения проницаемости капилляров, в большей мере воздействующих
на базальные мембраны. Подвергающиеся воздействию коллагеновые волокна
этих мембран еще больше усиливают агрегацию тромбоцитов.
Предотвращение
отторжения трансплантата
ЛЕКАРСТВЕННАЯ ИММУНОСУПРЕССИЯ
Разработка иммуносупрессивных препаратов
сделала революцию в трансплантологии. В большинстве случаев, если прекращается
прием этих препаратов, возникает реакция отторжения трансплантата.
Теоретически имеется несколько путей подавления
реакции отторжения: 1) разрушить иммунокомпетентные клетки перед трансплантацией;
2) сделать реактивные лимфоцитарные клетки неспособными распознавать антигены
или даже выработать токсическую реакцию против них; 3) повлиять на реакцию
клеток реципиентов с антигенами; 4) ин-гибировать трансформацию и пролиферацию
лимфоцитов; 5) ограничить дифференцировку лимфоцитов до Т-киллеров или
до синтезирующих антитела плазматических клеток; 6) активировать достаточное
количество лимфоцитов-супрессоров; 7) подавить разрушение клеток трансплантата
Т-киллерами; 8) повлиять на взаимодействие иммуногло-булинов с антигенами-мишенями;
9) предотвратить повреждение ткани неспецифическими клетками или иммунными
комплексами; 10) вызвать истинную специфическую иммунологическую толерантность
к антигенам трансплантата.
АНТИПРОЛИФЕРАТИВНЫЕ ПРЕПАРАТЫ
Наиболее традиционные иммуносупрессивные
препараты действуют как вещества, ухудшающие пролиферацию лимфоцитов. К
таким препаратам относятся антиметаболиты, алкилирующие вещества, токсичные
антибиотики и радиоизотопы. Они подавляют весь иммунный ответ за счет предотвращения
дифференцировки и деления иммунокомпетентных клеток после их встречи с
антигеном. Все они, однако, подпадают под одну из двух, широких категорий.
Либо они структурно напоминают необходимые метаболиты, либо образуют комбинации
с определенными компонентами клетки, такими как ДНК, и тем самым вмешиваются
в функционирование клетки.
Пуриновые аналоги. Пуриновый аналог
азатиоприн (имуран) — препарат, наиболее широко используемый при трансплантации
органов. Азатиоприн представляет собой б-меркаптопурин + боковая цепь,
защищающая лабильную сульфгидрильную группу. В печени боковая цепь отщепляется
и образуется активное вещество — 6-меркаптопу-рин. Его основной токсический
эффект состоит в угнетении кроветворения, ведущем к лейкопении. Характерен
также гепатотоксический эффект, вероятно, из-за высокого уровня синтеза
РНК этими клетками.
Циклоспорины. Циклоспорины — совершенно
новый класс иммуносупрессивных препаратов. Это циклические пептиды, продуцируемые
грибками (рис. 10.1). Многие из их супрессивных эффектов специфичны для
Т-лимфоцитов. Воздействие циклоспорина на лимфоциты приводит к угнетению
синтеза ими ИЛ-2. Однако если Т-лимфоциты активировались, циклоспорин не
способен подавить иммунный ответ (рис. 10.2).
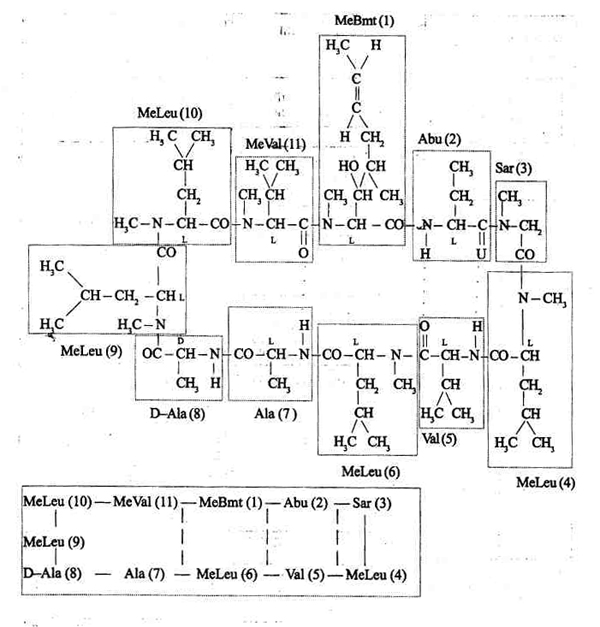
Рис. 10.1. Молекулярная структура
(вверху) и последовательность аминокислот (внизу) в циклоспорине.
Уникальной структурой в позиции 1; является MeBmt, новая ненасыщенная
В-гидрокси-9-карбоновая аминокислота: (4Н-4-[(Е)-2-бутенил)]-4, N-диметил-L-треонин.
Обозначения: Abu —а-аминобутировая кислота, Sar — саркозин,
MeLeu — N-Meran-L-лейцин, Val — валин, Ala -L-аланин*
D-Ala — аланин и MeVal — М-метил-Ь-валин. (По- Starzl
Т. Е., Shapiro R., Simmons R. L. [eds] /./ Atlas of organ transplantation.
— N.Y.: Gower Med. Pub!., 1992. — P. 1. 24.)
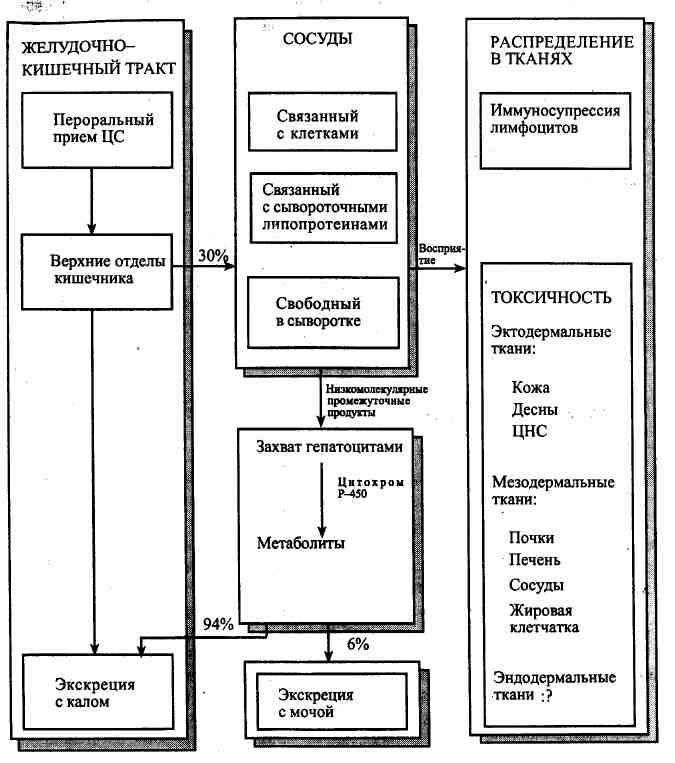
Рис. 10.2. Фармакодинамика
циклоспорина (ЦС). Препарат всасывается в желудочно-кишечном тракте
и поступает в сосуды, где значительная его часть связывается с клетками,
а наибольшая — с липопротеинами, при этом только небольшая его фракция
остается «свободной». Поступление препарата в ткани вызывает иммуносупрессию
лимфоидных клеток, с одной стороны, и токсическое повреждение эктодермальных
и мезодермальных структур — с другой. После захвата препарата гепатоцитами
он метаболизируется в них с участием цитохрома Р-450, что сопровождается
продукцией метаболитов, которые выделяются главным образом в желчь и в
меньшей степени экскретируются с мочой. Обозначения: ЦНС — центральная
нервная система. (По: Starzi Т. Е., Shapiro R., Simmons R. L [eds]
//Atlas of organ transplantation. — N. Y.: Gower Med. Publ., 1992. - P.
1. 26.)
Побочные эффекты циклоспорина — гирсутизм,
нейротоксичность, гйпер-калиемия, нефро- и гепатотоксичность. Наиболее
частыми токсическими эффектами являются поражение почек, гипертония и тремор.
Клинические испытания с пересадкой почек, печени, легких, сердца и тонкой
кишки показали, что циклоспорин обеспечивает потенциальную иммуносупрессию
без подавления кроветворения, характерного для антиметаболических препаратов.
FK506. Антибиотик из группы макролидов,
который, как и циклоспорин, имеет грибковое происхождение. Как и циклоспорин,
FK506 угнетает активацию клеток, но не предотвращает функционирование ранее
активированных Т-лимфоцитов. Его механизм воздействия связан с угнетением
продукции ИЛ-2. Хотя он угнетает продукцию интерлейкина-3 (ИЛ-3) и интерферона-у
(ИФН-у), но не подавляет гемопоэз. ^Предварительные клинические испытания
выявили два основных побочных эффекта: 1) анорек-сию и похудание и 2) нефротоксичность,
связанную с изменениями сосудов, включая фибриноидный некроз мелких артерий
и артериол. Выраженность этих эффектов зависит от дозы препарата.
ИММУНОСУПРЕССИЯ ЗА СЧЕТ УМЕНЬШЕНИЯ
ЧИСЛА ЛИМФОЦИТОВ
Кортикостероиды. Стероиды проникают через
клеточную мембрану и связываются со специфическими рецепторами цитоплазмы
большинства клеток. Комплекс стероид—рецептор затем проникает в ядро и
взаимодействует с ДНК за счет механизма, который неизвестен. Синтез ДНК,
РНК и белков угнетается, так же как и транспорт глюкозы и аминокислот.
При значительных дозах стероидов возникают дистрофические и некротические
изменения лимфоцитов. Цитолиз может быть легко вызван in vivo, при этом
Т-лимфоциты представляются наиболее восприимчивыми. Основное противолимфоцитарное
действие стероидов может состоять в истощении пула малых лимфоцитов, прежде
чем они будут активированы антигеном. Стероиды также угнетают большинство
вспомогательных функций макрофагов, включая их способность секретировать
ИЛ-1. Хотя стероиды относительно не влияют на активность В-лимфоцитов и
продукцию антител, они повреждают многие другие типы клеток, участвующих
в отторжении трансплантата. Угнетаются хемотаксис и фагоцитоз как макрофагов,
так и нейтрофилов. Уменьшается накопление нейтрофилов, макрофагов и лимфоцитов
в зоне иммунной и воспалительной активности. Назначение одних только стероидов
не может предотвратить клинических проявлений отторжения трансплантата,
но в сочетании с другими препаратами они способны как предотвращать, так
и подавлять реакции отторжения. Характерными проблемами, возникающими при
стероидной терапии, являются гипертония, ожирение, изъязвления и кровотечения
из желудочно-кишечного тракта, эйфорическое изменение личности, образоваше
катаракты.шшергликемия вплоть до стероидного диабета и остеопороз с аваскуляряым
некрозом костей.
Антилимфоцитарный глобулин. Гетерологичные
антилимфоцитарные глобулины (АЛГ) продуцируются, когда лимфоциты из грудного
протока, периферической крови, лимфатических узлов, вилочковой железы или
селезенки, вводятся в кровь животным других видов. Для клинической трансплантологии
с этой целью обычно используются кролики и лошади. Антитела, выработанные
таким грубым способом, поликлональны и поэтому реагируют с целым рядом
эпитопов введенных лимфоцитов различных типов.
Действие гетерологичных поликлональных
АЛГ проявляется главным образом против Т-лимфоцитов. АЛГ поэтому вмешиваются
в большинство клеточно-опосредованных реакций — реакцию отторжения трансплантата,
реакцию на туберкулин и реакцию «трансплантат против хозяина».
Хотя эти препараты, назначавшиеся в очищенном
виде внутривенно, широко с успехом используются в клинической трансплантологии
как для предупреждения, так и для борьбы с отторжением трансплантата, теперь
в распоряжении клиницистов имеются моноклональные антитела с более предсказуемой
реактивностью.
Моноклональные антитела используются в
клинической практике для контроля за реакцией отторжения и мониторинга
изменений субпопуляций лимфоцитов во время проведения иммуносупрессивной
терапии. Их прототипом являются ОКТЗ. ОКТЗ •— моноклональные а/нтитела
против антигена CD3, которые присоединяются к рецепторному комплексу (CD3)
Т-лимфоцитов, имеющемуся на поверхности всех зрелых Т-лимфоцитов. Поскольку
рецептор CD3, к которому прикрепляются ОКТЗ, представляет собой сигнальную
часть рецепторного комплекса Т-лимфоцитов, функция этих лимфоцитов угнетается.
Токсичность любых гетерологичных антител,
выработанных против , тканей человека, отчасти зависит от их перекрестного
реагирования с другими тканевыми антигенами и отчасти — от возможности
самого организма вырабатывать антитела против чужеродных белков. Поликлональ-ные
АЛГ могут вызывать анемию и тромбоцитопению, несмотря на их предварительную
абсорбцию тромбоцитами и эритроцитами. Для моно-клональных антител характерны
незначительные перекрестные реакции, но лихорадка, озноб, тошнота, диарея
и асептический менингит часто наблюдаются во время введения первых нескольких
доз сыворотки. Все гетерологичные глобулины могут сопровождаться
аллергическими реакциями на них. Эти реакции обычно легкие и нечастые,
но моноклональные антитела являются сильными антигенами, так что после
одной или двух йедель в результате формирования направленных против них
антител они становятся менее эффективными.
Облучение. Общее облучение организма имеет
ограниченное примене-ние клинической трансплантологии, поскольку токсический
эффект слишком выражен. Исследуется возможность применения облучения дробными
дозами лимфоидных тканей (тотальное лимфоидное облучение), подобного тому,
которое применяется при лечении болезни Ходжкина (Hqdgkin).
ОСЛОЖНЕНИЯ ИММУНОСУПРЕССИИ
Инфекции, тяжелые токсические поражения
органов и появление злокачественных опухолей — наиболее частые осложнения,
связанные с применением неспецифических иммуносупрессоров. Иногда реакцию
отторжения не удается контролировать и она может возникнуть, несмотря на
проведение комплексной терапии.
Инфекционные осложнения. Иммуносупрессия
из-за ее неспецифического механизма действия увеличивает риск инфекционных
осложнений, вызываемых вирусными, грибковыми и бактериальными возбудителями.
В настоящее время применение более эффективных антибиотиков и иммуносупрессоров
сместило спектр микробов в сторону оппортунистических чюзбудителей, которые
в норме слабо патогенны или вовсе не патогенны.
Вирусные инфекции. Среди больных
с пересаженными почками'широко распространены вирусные инфекции. Группа
герпетических ДНК-вирусов относится к наиболее частым этиологическим факторам.
Инфициро-вание или наличие антител к цитомегаловирусу (ЦМВ) выявляется
у 50-90% больных с пересаженными почками. Инфицирование вирусом Эпштейна—Барр
(Epstein—Barr), сопровождающееся посттрансплантационным возникновением
злокачественных опухолей, встречается, однако, редко. Профилактическое
использование противовирусных препаратов ацикловира и ганцикловира привело
к значительному снижению вирусных осложнений.
Наличие антигенов вируса гепатита В после
пересадки органов может быть обнаружено у многих больных, а гепатит «ни
А, ни В», вероятно, служит причиной печеночной недостаточности у некоторых
долго проживших пациентов.
ЦМВ — наиболее важное инфекционное осложнение
иммуносупрёссии в посттрансплантационном периоде. ЦМВ-инфекция может вызывать
спектр характерных болезненных явлений в виде лихорадки, нёйтропении, артралгий,
слабости, миокардита, панкреатита или язв желудочно-кишечного тракта. Наибрльшую
группу риска составляют реципиенты, которые не имеют антител против ЦМВ
и которым были пересажены органы от доноров, имевших такие антитела.
Злокачественные опухоли. Такие опухоли
неожиданно часто сопровождают пересадку органов. Частота злокачественных
опухолей не столь высока, однако представляет известное противопоказание
для пересадки органов. У пациентов после пересадки возникают два основных
типа опухолей: лимфомы и раки Кожи. Неумышленная пересадка злокаче:
ственной опухоли из трупа донор у которого не подозревали ее
наличия , является редкой причиной.
Наиболее частые злокачественные опухоли
— это первичные опухоли у реципиентов, получающих иммуносупрессивную терапию.
75% злокачественных опухолей имеют либо „эпителиальное, либо лимфоидное
происхождение. Рак in sity шейки матки, рак губы и плоскоклеточный яйи
базальноклеточный рак кожи составляют примерно половину этой груд-пы, тогда
как другую половину — В-клеточные лимфомы. Подсчитано, Что у пациентов
после трансплантации риск развития рака шейки матки, рака кожи или лимфомы
возрастает соответственно в 4, 40 и 350 раз. Лимфомы оказываются необычными
не только по их частоте, но и по биологическому поведению.
Результаты недавних исследований убеждают
в том, что не все лимфомы относятся к истинным опухолям. Иммунологический
анализ показал, что эти опухоли секретируют различные типы иммуноглобулинов,
т. е. они не моноклональны, как это должно быть при злокачественных лимфомах.
Большинство фактов убеждает в то^л, что некоторые из них могут представлять
неконтролируемую В-клеточную пролиферацию в ответ на вирус Эпштейна—Барр
у серонегативных пациентов. На этой стадии антивирусная терапия ацикловиром
представляется многообещающей.
Синдром Иценко—Кушинга. У большинства
пациентов, получающих стероидную терапию после пересадки органов, развивается
синдром Иценко—Кушинга.
Желудочно-кишечные кровотечения. Такие
кровотечения в результате обострения ранее существовавшей хронической язвы
или диффузных острых язв желудка и кишечника могут оказаться смертельными.
Другие кишечные осложнения. Иммуносупрессивную
терапию сопровождает целый ряд кишечных осложнений, в том числе дивертикулит,
кишечное кровотечение или изъязвление. Синдром острых язв слепой кишки
с кровотечением служит проявлением ЦМВ-инфекции. Последняя лежит также
в основе возникновения острых язв в других отделах кишечника.
Катаракта. Часто возникает у больных,
получающих стероидную терапию. Катаракта, которая развивается медленно,
похоже, не зависит от дозировки преднизона.
Гипертония. Многие из больных, нуждающихся
в пересадке почек, уже имеют повышенное артериальное давление. Гипертония,
очевидно, связана не только с преднизоном, но также с недостаточностью
регуляции водно-натриевого обмена в раннем посттрансплантационном периоде
и с секрецией ренина почками. Гипертония также является хорошо известным
побочным эффектом циклоспорина.
Нарушения обмена кальция. У больных,
нуждающихся в пересадке почек, часто наблюдается почечная остеодистрофия.
Иногда для прекраще- ний прогрессирования поражения костей требуется паратиреоидэктомия,
однако только гиперкальциемия после трансплантации не является показанием
к этой операции.
Осложнения со стороны опорно-двигательной
системы. Грозным осложнением хронического применения неспецифических
иммуно-супрессоров является аваскулярный некроз головки бедренной кости
и других костей. Его частота сильно коррелирует с дозами стероидных препаратов.
'Панкреатит. У больных, перенесших
пересадку органов, заболевание может появляться внезапно и неожиданно,
а его рецидив может оказаться фатальным. Возникновение панкреатита связывают
с кортикостероидной терапией, действием азатиоприна, ЦМВ-инфекцией или
инфицированием вирусами гепатита.
Рост. После успешной трансплантации
темпы роста у детей значительно варьируют и могут зависеть от возраста,
прежних темпов роста, функции почек и режима приема иммуносупрессоров.
У многих детей восстанавливается нормальный темп роста; к сожалению, недостаток
роста за время заболевания не компенсируется.
Беременность. Многие дети от женщин
с пересаженными почками рождаются нормальными, несмотря на прием матерями
иммуносупрессоров. Беременность у женщин с пересаженными почками, однако,
часто осложняется токсикозом, бактериальной и вирусной инфекциями, особенно
инфекцией мочевыводящих путей.
Пересадка
костного мозга
Аутотрансплантация костного мозга и его
пересадка от однояйцевых близнецов проводятся весьма успешно. Эти методы
используют для лечения лучевой болезни, апластической анемии и лейкозов.
Поскольку донорские клетки костного мозга идентичны таковым у реципиента,
пересаживаемый костный мозг хорошо воспринимается его организмом, и реакция
«трансплантат против хозяина» (см. ниже) не возникает. Аутологичная (от
самого себя —. себе же) трансплантация костного мозга делает возможной
химиотерапию злокачественных опухолей в гораздо больших дозах без вынужденного
поражения костного мозга, которое обычно наблюдается как побочный эффект
противоопухолевых препаратов, связанный с быстрым делением костномозговых
клеток.
Аллогенная трансплантация успешно применяется
при ряде заболеваний. К восприятию донорского костного мозга организм реципиента
должен быть подготовлен применением фармакологических препаратов или облучения
для уничтожения стволовых клеток в его костном мозгу. Это обычно делается
при лейкозах, при которых желаемым результатом является полное замещение
костного мозга (а следовательно, и пула опухолевых клеток) реципиента донорским.
В отличие от других видов трансплантации, если донорский костный мозг прижился
у реципиента,' никакой постоянной иммуносупрессии в: дальнейшем
не требуется. Такая трансплантация ведет к химерическому состоянию, когда
в организме сосуществуют ткани (реципиента и донора) от генетически отличающихся
организмов. Действительно, пересадка костного мозга дает уникальную возможность
придать организму толерантность в форме постоянной восприимчивости к трансплантатам
, для последующих пересадок тканей и органов. Организм реципиента становится
толерантным к донорским тканям и воспринимает их как свои собственные.
Однако, если вместе с пересаживаемым донорским костным мозгом пересаживаются
и зрелые Т-лимфоциты, они могут атаковать организм реципиента, который
для них антигенно чужероден, что ведет к развитию реакции «трансплантат
против хозяина» (ТПХ). Клетками-мишенями для донорских Т-лимфоцитов при
этом служат и эпителиоциты реципиента, в том числе эпителий кожи, печени
и желудочно-кишечного тракта, что сопровождается появлением генерализованной
сыпи, печеночной недостаточности, диареи и истощения. Чем значительнее
генетические различия между реципиентом и донором, тем выраженнее реакция
ТПХ.
Хотя ранее считалось, что реакция ТПХ не
может возникать при отсутствии донорского костного мозга, теперь стало
ясно, что это не так. Для развития реакции ТПХ существенны три фактора:
1) распознаваемые антигенные различия между донбром и реципиентом, 2) иммунокомпетентность
донорских Т-лимфоцитов и 3) относительная иммунная недостаточность у реципиента.
Использование трансплантации костного мозга
для создания толерантности к пересаживаемым в дальнейшем органам, таким
как печень, сердце и почки, рассматривается как потенциальный прием, позволяющий
обеспечить больному длительное отсутствие у него реакции отторжения пересаженного'органа
без постоянной неспецифической иммуносупрессии. Значительный опыт в этом
направлении имеется в эксперименте с разными видами животных, и в настоящее
время на пути к клиническому внедрению метода достигнут определенный прогресс.
Пересадка
органов
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Теперь выявлено, что сахарный диабет I
типа — это истинное аутоиммунное заболевание, при котором утрачивается
иммунологическая толерантность к собственным тканям, что сопровождается
иммунной атакой этих тканей. У больных сахарным диабетом в 17 раз чаще
наблюдаются поражения почек, в 5 раз — гангрена конечностей, примерно в
2 раза — сердечные заболевания. Диабет сегодня в США стал причиной номер
один почечной недостаточности, требующей гемодиализа или пересадки почек.
Различные наблюдения поддерживают гипотезу
о том, что ангиопатии отчасти связаны с сахарным диабетом зи нарушениями
метаболизма.
1. Нефропатия и ретинопатия отмечаются
у больных,, у которых сахарный диабет развился в результате других болезненных
состояний.
2. Многочисленные продолжительные клинические
исследования продемонстрировали связь между длительностью заболевания,
контролем за уровнем глюкозы в плазме крови и развитием поражений.
3. У животных с экспериментальным сахарным
диабетом развиваются нефропатия и ретинопатия.
4. Исследования, проведенные на животных,
показали, что уменьшение гцПергликемии за счет инсулинотерапии, пересадки
целрй поджелудочной железы или только островков Лангерганса предотвращает
или сводит до минимума диабетические поражения глаз, почек и нервов.
5. При пересадке почек от нормальных крыс
крысам с экспериментальным сахарным диабетом в этих почках развиваются
гистологические изменения, характерные для диабета, тогда как пересадка
здоровым крысам почекч?от животных, страдающих диабетом, сопровождается
исчезновением или затормаживанием прогресса заболевания.
Современная техника выделения островков
Лангерганса из поджелудочной железы состоит в ее механическом разрушении,
ферментной обработке и разделении по градиенту плотности. Инфузия в воротную
вену выделенных островков взрослых особей сопровождается продолжительным
контролем за уровнем глюкозы в крови у крыс с сахарным диабетом. Эта методика
была также успешно использована для аутотрансплан-тации островков у людей,
которым была выполнена тотальная панкреатэктомия по поводу хронического
панкреатита.
Было выполнено более 100 переездов островков
Лангерганса. Сейчас доказано, что трансплантация островков, продуцирующих
инсулин, достаточна для обеспечения нормального обмена глюкозы. Клиническое
применение аллотрансплантации островков ограничивается явным нарастанием
чувствительности к антигенам островков с развитием реакции отторжения трансплантата.
Длительное выживание трансплантата трудно достижимо, даже при применении
иммуносупрессии, обеспечивающей длительное функционирование кожных, почечных
или сердечных трансплантатов.
К октябрю 1990 г. было выполнено более
3800 клинических пересадок поджелудочной железы. Обычно используются трупные
органы, а у большинства реципиентов уже имеется финальная стадия почечной
недостаточности. Почки и,поджелудочная железа пересаживаются одномоментно.
Все шире, однако, по мере развития успеха выполняется пересадка поджелудочной
железы еще до возникновения тяжелого поражения почек. Действительно, у
25% всех больных, перенесших пересадку поджелудочной железы в 1986-1990
гг., одновременная пересадка почек не производилась.
Успешная пересадка целой поджелудочной
железы или ее сегментов сопровождается нормализацией уровня инсулина и
глюкозы в крови.
С реакцией отторжения трансплантата так
же трудно бороться, как и диагностировать ее. К тому времени, когда уровень
глюкозы становится ненормальным, отторжение обычно оказывается далеко зашедшим
и необратимым. Активность ферментов в сыворотке крови не повышается и поэтому
не может быть использована для диагностики начинающегося отторжения. Однако,
когда создается анастомоз между панкреатическим протоком и мочевым пузырем,
может быть проконтролирован уровень амилазы мочи. При отторжении трансплантата
он рано понижается. Таким образом, наиболее удачное техническое решение
также позволяет улучшить иммуно< логический контроль за реакцией отторжения.
Опыт пересадки поджелудочной железы у людей
показал, что васкуля-ризированный аллотрансплантат корректирует метаболические
нарушения при сахарном диабете. Выживаемость трансплантата неуклонно повышается;
у больных, которым пересадка была осуществлена в период 1988-1990 гг.,
чуть более 60% трансплантатов функционировали на протяжении 36 мес, тогда
как у перенесших операцию в 1978-1982 гг. — только 18%.
ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ
С возрастающим успехом производится
пересадка нескольких органов брюшной полости, в том числе печени — двенадцатиперстной
кишки — поджелудочной железы, печени — желудка — двенадцатиперстной кишки
— поджелудочной железы или печени и кишечника одним блоком. «Кластерные»
трансплантации производятся после удаления у реципиента печени, поджелудочной
железы, желудка, селезенки, двенадцатиперстной и проксимальной части тощей
кишки. Большинство таких операций выполняется по поводу экстенсивного,
но локализованного внутрибрющ-ного опухолевого поражения с вовлечением
печ.ени или поджелудочной железы. :
В клинике теперь выполняется аллотрансплантация
тонкой кишки. Имеется ряд сообщений об успешных операциях. Хотя успеху
противостоит реакция ТПХ из-за большого количества лимфоидной ткани в кишке,
это существенным образом не ограничивает возможность проведения операции.
Чаще всего реципиентами бывают дети, у которых кишка была резецирована
по поводу ее заворота или некротического энтероколита.
ПЕЧЕНЬ
Пересадка печени послужила успешным решением
проблемы, связанной у тысяч пациентов с рядом врожденных или приобретенных
ее поражений. Пересаживаемая печень обычно помещается на место ее нормальной
анатомической локализации (ортотопическая пересадка) после тотальной гепатэктомии
у реципиента.
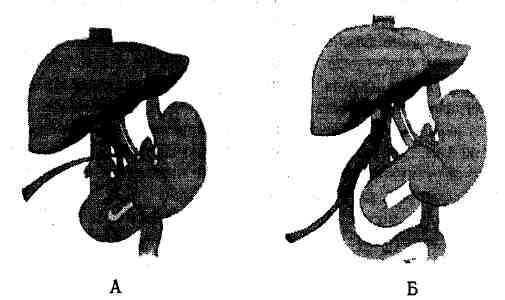
Рис. 10.3. Выполнение ортотопической
трансплантации печени у взрослого (А) и у ребенка (Б). Показаны
два наиболее предпочтительных метода реконструкции жел-чевывОдящих путей.
(По: Ascher N. /., Najarian J. S. et. at. Manual of vascular
access, organ donation, and transplantation / Eds R. L. Simmons et al.
— N.Y.: Springer Verlag, 1984)
Показания. Теоретически пересадка
печени показана при любом заболевании, приводящем к печеночной недостаточности.
У детей наиболее частым показанием к трансплантации служит атрезия внепеченочных
желче-выводящих путей. Пересадка противопоказана следующим больным: 1)
с плохо поддающимися лечению'инфекционными заболеваниями, 2) с обширным
опухолевым поражением, 3) с конкурирующей патологией (например, сердечной
недостаточностью, пожилым возрастом), которая существенно ухудшает выживаемость,
4) с вцсоким риском рецидива заболевания в пересаженном органе; Поскольку
активный гепатит обычно рецидивирует, наличие в крови антигенов HBs
и НВе может быть относительным противопоказанием. У детей размеры
органа являются главным препятствием при пересадке печени и ограничивают
число возможных донорских органов. Пересадка печеночных трансплантатов
уменьшенных размеров обеспечивает решение этор проблемы.
Методика. Пересадка печени — относительно
простая процедура, хотя избыточное кровотечение, связанное с экстенсивным
расширением венозных коллатералей в результате портальной гипертензии,
делает удаление собственной печени реципиента наиболее сложной частью операции.
Если технические сложности препятствуют завершению пересадки печени, пациент
обычно умирает.
У детей донорская печень может быть меньше
на 20%, JHO мо'жет быть лишь минимально больше требующейся.
Анастомозы аллотрансплантата показаны на
рис. 10.3. Труднее всего выполнить надпеченочный кавальный анастомоз. Вторым
анастомозом обычно делается анастомоз воротной вены, чтобы минимизировать
венозный застой в кишечнике. После подшивания воротной вены следует на
короткое время убрать зажимы с подпеченочной части полой вены, оставив
ее пережатой в надпеченочной зоне. С воротной вены зажим снимается, чтобы
обеспечить перфузию органа теплой кровью. Эта последовательность используется
для того, чтобы удалить из печени холодный перфузат и предотвратить системную
гипотермию и гепаринизацию. Коль скоро перфузат вымыт из печени и она становится
уплотненной и розовой, накладывается зажим на подпеченочную часть полой
вены, а с надпеченочной зажим снимается. После этого выполняются анастомозы
между остальными (печеночная артерия, нижняя полая вена) сосудами.
После создания анастомозов между сосудами
должен быть обеспечен отток желчи. У взрослых предпочтительней непосредственное
сшивание участков желчных протоков. У детей предпочтение отдается холедохоею-ностомии.
Послеоперационное лечение. Лечение
пациентов в раннем посттрансплантационном периоде настолько сложное, что
требуется разработка специальных протоколов, гарантирующих, что ключевые
детали не окажутся упущенными. Если функция почек удовлетворительна, иммуно-супрессию
предпочтительно проводить с помощью циклоспорина и пред-низона. Если функция
почек плохая, то циклоспорин не используют, а применяют антилимфобластную
сыворотку, пока не будет достигнута стабилизация состояния больного в раннем
послеоперационном периоде. Обязательный мониторинговый контроль за функционированием
печеночного трансплантата осуществляется путем биохимического определения
показателей коагуляции (особенно протромбинового времени, уровня фактора
V, сывороточного билирубина, активности трансаминаз и щелочной фосфатазы).
Изменение этих показателей может сигнализировать о реакции отторжения трансплантата,
ишемии, вирусной инфекции, холанги-те или механической обструкции.
В ходе реакции отторжения лимфоциты инфильтрируют
портальные тракты и центральные вены с повреждением эпителия желчных протоков
различной степени; поэтому чрескожная биопсия и микробиологическое исследование
представляются единственной возможностью различить реакцию отторжения,
ишемию, вирусную инфекцию и холангит. По поводу отторжения трансплантата
вначале внутривенно применяются стероиды, ОКТЗ или антилимфобластные глобулины.
Присутствие ПМЯЛ в портальных трактах указывает на холангит. Пациентам
назначают антибиотики и проводят обследование на предмет выявления механической
обструкции как возможной причины холангита. ЦМВ-гепатит лечится ганцикловиром.
Последние протоколы, в которых этот препарат
используется с профилактической целью, показали более низкую частоту угрожающих
жизни инфекционных осложнений.
Послеоперационные осложнения. Наиболее
серьезным осложнением'является первичное нефункционироватше органа, при
котором функция пересаженной печени оказывается недостаточной для жизнеобеспечения
организма. Это может быть связано с ишемией, техническими факторами или
ускоренной реакцией отторжения.8 Первичное ^функционирование
должно быть заподозрено в первую очередь, когда уровень фактора V в крови
необратимо снижается.
Интраоперационное кровотечение случается
по многим причинам; выраженное портокавальное шунтирование имеет место
почти всегда, а нарушения коагуляции — практически всегда. Даже когда в
ходе операции достигнут адекватный гемостаз, всегда существует особая опасность
кровотечения в ближайшем послеоперационном периоде. При ушивании брюшной
полости необходимо измерить показатели коагуляции, в том числе количество
тромбоцитов и уровень кальция, чтобы при необходимости внест» соответствующие
коррективы.
Тромбоз печеночной артерии или воротной
вены вызывает внезапное нарушение функции печени. Показатели уровня билирубина
и активности трансаминаз резко возрастают, появляются признаки нарушения
свертываемости крови, гиперкалиемия и гипогликемия, а при сканировании
выясняется, что печень не поглощает изотоп.
Профилактическое пероральное назначение
бактрима, так же как и при пересадке почек, уменьшает частоту послеоперационных
инфекций, вызываемых Pneumocistis carinii и Nocardia.
Вирусные инфекции представляют собой основную
проблему. Наиболее серьезной является ЦМВ-инфекция, по поводу которой назначают
лечение ацикловиром или ганцикловиром.
Протекающие субклинически обратимые эпизоды
отторжения обычно выявляются при пункционной биопсии печени, если та выполняется
еженедельно. Отторжение трансплантата может возникнуть после операции в
любое время, в том числе в первые 24 ч, но в большинстве случаев оно отмечается
как минимум через несколько недель после пересадки.
Результаты пересадки. Хотя первая пересадка
печени была осуществлена еще в 1963 г., операции не были успешными до 1967
г. С этого времени до 1978 г. результаты операции были плохими, с 25-30%
однолетней выживаемостью. Дополнение циклоспорина к преднизону или применение
преднизона с азатиоприном привело к существенному улучшению исходов с подъемом
показателя однолетней выживаемости до 80%. Пересадка печени в настоящее
время рассматривается как метод выбора при лечении финальной стадии печеночной
недостаточности любого генеза.
ПЕРЕСАДКА СЕРДЦА
История. После того как в 1967 г.
Кристианом Бернаром (Christiaan Barnard) была выполнена первая пересадка
сердца у человека, во всем мире стали производиться многочисленные попытки
аналогичных операций. Разочаровывающие первые результаты привели к ослаблению
интереса к операции.
Показания. Большинство случаев, требующих
пересадки сердца, подпадает под категорию конгестивной кардиомиопатии,
которая представляет собой группу заболеваний различного генеза. i «Идиопатические»
кардиомиопатии — гетерогенная группа заболеваний, составляющих существенную
долю среди причин финальной стадии патологии, характеризующаяся расширением
камер сердца, дистрофическими изменениями миокарда и кардиосклерозом. В
качестве этиологического фактора большинства «идиопатических» кардиомиопатии
рассматривают вирусные инфекции.
Ишемическая кардиомиопатия является конечным
проявлением коронарного атеросклероза. По сравнению с больными с идиопатической
кардиомиопатией пациенты с ишемической кардиомиопатией в целом старше и
у них чаще встречаются такие сопутствующие проблемы, как сахарный диабет
и заболевания периферических сосудов. 90% больных, подвергающихся пересадке
сердца, страдают либо идиопатической (49%), либо ишемической (41%) кардиомиопатией.
У 10% имеется финальная стадия желудочковой недостаточности, связанная
с поражением клапанов, или не подлежащий реконструкции врожденный порок
сердца. У детей эти пропорции другие: ,93% всех заболеваний в целом составляют
идиопатическая кардиомиопатия (49%) и врожденные пороки сердца (44%).
Отбор реципиентов. Реципиенты отбираются
из числа больных с финальной стадией желудочковой недостаточности III-IV
класса по клинической классификации Нью-Йоркской кардиологической ассоциации,
которые вряд ли проживут без операции более года и для которых не существует
альтернативных методов лечения.
К противопоказаниям относятся системные
заболевания, которые могут неблагоприятно влиять на выживаемость, такие
как злокачественные опухоли, тяжелое поражение периферических сосудов или
аутоиммунный вас-кулит и почечная или печеночная дисфункция, и которые
вряд ли'исчезнут после улучшения сердечного выброса.
Оценка донора. Время ишемии (время
между остановкой коронарного кровообращения и его восстановлением в уже
пересаженном сердце) в идеале должно быть менее 4ч. Проводится подбор по
размерам, чтобы избежать серьезных несоответствий при создании предсердных
и сосудистых анастомозов и нарушений гемодинамики. Крайне важным методом
исследования служит эхокардиография, позволяющая оценить сократимость сердца
и выявить очаговые нарушения сократительной функции.
Операция у реципиента. С цельно
минимизации времени ишемии поддерживается тесный контакт с хирургической
бригадой, обеспечивающей забор донорского сердца, чтобы имплантация началась
как можно скорее после доставки донорского сердца в операционную. Аорту
реципиента пережимают поперек непосредственно перед отхождением от нее
плечеголовного ствола, сердце удаляют путем пересечения магистральных сосудов
у их'комиссур и отделения предсердий от желудочков по атриовентрикулярной
борозде. Оба ушка предсердий иссекают. Задние отделы обоих предсердий оставляют
интактными и соединенными межпредсердной перегородкой. Донорское сердце
вынимают из транс-портировочного контейнера и обрезают его соответствующим
образом. Имплантацию осуществляют . путем последовательного пришивания
трансплантата к левому предсердию, к правому предсердию, к легочному стволу
и к аорте. Поперечный зажим снимают, и восстанавливается спонтанный ритм.
Синусовый узел донорского сердца становится ведущим водителем ритма. Собственный
ритм реципиента часто персистирует, вызывая регулярные непроводящиеся сокращения
ткани собственных предсердий и независимую волну Р на электрокардиограмме
после трансплантации.
Иммуносупрессия. Наиболее часто
используемой комбинацией препаратов является ежедневный пероральный прием
циклоспорина, азати-оприна и преднизона. Дозировка циклоспорина подбирается
так, чтобы поддерживать его соответствующий уровень в сыворотке крови.
Побочные эффекты циклоспорина значительны и заключаются в нефротоксичности,
гипертонии, гирсутизме и гипертрофии десен. Изучается возможность использования
FK506, RS61443 и рапамицина как заменителей циклоспорина.
Отторжение трансплантата. Контроль
за реакцией отторжения трансплантата осуществляется путем эндомиокардиальных
биопсий правого желудочка, выполняемых не реже 1 раза в неделю в течение
1-го месяца, а затем не реже, чем указано в таблице контроля. Во время
каждой биопсии выполняется катетеризация правых отделов сердца. Большинство
эпизодов отторжения характеризуется нормальной гемо-динамикой, но снижение
сердечного выброса, оксигенации венозной крови и повышение давления в правом
предсердии или давления заклинивания заставляют заподозрить начинающееся
отторжение. Биопсия выполняется во время той же венепункции с помощью гибких
биопсион-ных щипцов, вводимых в правый желудочек. Гистологические признаки
некроза кардиомиоцитов (2-й или более степени) считаются диагностическим
признаком выраженной реакции отторжения. Воспалительная инфильтрация 1-й
степени рассматривается как патология, но в отсутствие некроза кардиомиоцитов
лечения по поводу реакции отторжения трансплантата не проводится. Все эпизоды,
подозрительные на реакцию отторжения, рассматриваются в клиническом конте-ксте,
особенно если результаты гистологического исследования неоднозначны.
\ Примерно 95% случаев реакции отторжения
первоначально лечат стероидами или в виде трехдневного перорального дополнительного
назначения преднизона с последующим уменьшением дозы к 7-10-му дню, или
в виде внутривенного введения метилпреднизона по 1 г в день в течение трех
дней. Пероральное или внутривенное лечение стероидами эффективно в 95%
случаев всех реакций отторжения, а в половине оставшихся случаев требуется
неотложная терапия. Больные, у которых первоначально возникает нестабильность
гемодинамики, представляют группу высокого риска и должны получать интенсивное
первоначальное лечение в виде внутривенного введения стероидов и цитолитиков.
Результаты. Однолетняя выживаемость
после операций пересадки сердца, выполненных в последние 5 лет, составляет
80% по сравнению с 73% в предыдущие 5 лет. Другими словами, пятилетняя
выживаемость сегодня является в принципе такой же, как и в начале прошедшей
декады. Результаты обследования функционального состояния больных через
2 года после пересадки сердца показали, что у 85% из них имеется сердечная
недостаточность I класса, а у 13% — II класса по классификации Нью-Йоркской
кардиологической ассоциации.
Однолетняя выживаемость в настоящее время
у больных в возрасте до 18 лет превышает 80%, а у больных в возрасте до
1 года повысилась до 70%.
Летальность в первые 30 дней стабильно
составляет 9-10%. Она связана с отторжением трансплантата или с инфекционными
осложнениями у 40% больных, а также с «сердечными» и другими ранними причинами
смерти, такими как плохой подбор донора, плохое сохранение донорского сердца
и препятствующая успеху легочная гипертензия у реципиента. Небольшое количество
пациентов с ранней дисфункцией донорского сердца можно поддержать, используя
средства для помощи левому желудочку. Циклоспорин и цитолитические препараты
значительно снижают частоту ранних летальных исходов, связанных с отторжением
трансплантата, но существенным образом не влияют на другие причины смерти.
ПЕРЕСАДКА ЛЕГКИХ И КОМПЛЕКСА «СЕРДЦЕ-ЛЕГКИЕ»
История. Первой пересадкой легких
была пересадка единственного легкого, выполненная в 1963 г. Харди (Hardy),
которая закончилась летально в ближайшем послеоперационном периоде. Вслед
за этой попыткой в течение следующих 20 лет было произведено 46 операций
пересадки единственного легкого, при которых летальность в первые 18 дней
составила более 80%, средняя продолжительность жизни после операции — 10
дней, а однолетняя выживаемость — 20%. Почти все летальные исходы были
связаны с несостоятельностью бронхиальных анастомозов.
Отбор реципиентов. Реципиенты, которым
нужна пересадка легких, это больные с финальной стадией поражения
легких, которая существенно ограничивает нормальную жизнедеятельность,
и с плохим прогнозом на ближайшие 1-2 года. Обструктивные/фиброзные заболевания
легких, такие как хроническая эмфизема, кистозный фиброз и идиопатический
фиброз легких — наиболее частые примеры таких легочных поражений. В отличие
от них заболевания легочных -сосудов, такие как первичная легочная гипертония
или синдром Айзенменгера (Eisenmenger), характеризуются правожелудочковой
сердечной недостаточностью с почти нормальной бронхоальвеолярной функцией.
Больным с не подлежащим коррекции пороком
сердца и финальной стадией синдрома Айзенменгера должна выполняться пересадка
комплекса «сердце—легкие».
Реципиенты, которым пересаживаются два
легких, подвергаются также сложной операции, но она выполняется не старым
больным (до 60 лет). Имеющийся в настоящее время опыт свидетельствует,
что пациенты с хронической эмфиземой чувствуют себя хорошо после пересадки
одного легкого. В различных трансплантологических центрах существует убеждение,
что пациентам с первичной или вторичной легочной гипертензией следует пересаживать
два легких во избежание острых или хронических проблем, связанных со сбросом
крови в сосуды пересаженного легкого.
Пересадка одного легкого технически проще,
чем пересадка двух легких или комплекса «сердце—легкие», и при отборе кандидатов
на такую операцию в число реципиентов могут включаться более пожилые больные
(до 65 лет).
Послеоперационное лечение. При пересадке
легких возникает особая (по сравнению с пересадкой других органов) проблема
в виде более частых и более серьезных осложнений, о которых всегда следует
думать, .когда изменения в рентгенографической картине или в составе газов
крови свидетельствуют о реакции отторжения трансплантата. По данным Регистра
Международного общества пересадки сердца и легких, инфекционные осложнения
служили непосредственной причиной смерти в 34% случаев пересадки комплекса
«сердце—легкие» и в 55% случаев пересадки одного легкого. Самую главную
трудность представляет дифференциальная диагностика реакции отторжения
трансплантата и вирусной пневмонии. Нередко правильный диагноз ЦМВ-поражения
легких основывается целиком лишь на обнаружении внутриклеточных телец в
ткани легкого, полученной путем трансбронхиальной биопсии.
В большинстве центров применяется иммуносупрессия
с использованием трех препаратов. Среди специалистов превалирует мнение,
что отторжение легочногб трансплантата возникает чаще, бывает более тяжелым
и более труднообратимым, чем отторжение пересаженного сердца, и иммуносупрессия
при пересадке легких должна быть соответственно боле.е агрессивной. . ,..;...
При пересадке единственного легкого возникает
уникальная проблема, связанная с существованием у реципиента второго собственного
легкого.
У-реципиентов с хронической эмфиземой большая
податливость собственного легкого сопровождается его перерастяжением при
вентиляции с положительным давлением, что может вызвать значительное смещение
органов средостения, способное отрицательно влиять на возврат венозной
крови и газообмен.
Больные с пересаженным комплексом «сердце—легкие»
в раннем послеоперационном периоде нуждаются в инотропной и хронотропной
прдт держке денервированного сердца и, помимо риска отторжения легочного
трансплантата, еще подвержены риску отторжения пересаженного сердца. Отторжение
сердца и легких может развиваться независимо друг от друга, По причине,
которая не вполне ясна, отторжение сердечного трансплантата при пересадке
комплекса «сердце—легкие» возникает значительно реже (р<0,01), чем при
пересадке одного только сердца. Эндомиокардиальные биопсии у таких пациентов
проводятся по программе с уменьшающейся частотой и через 1 год становятся
ненужными.
Результаты. К концу 1991 г. за 10
лет было выполнено 1212 пересадок комплекса «сердце—легкие». Однолетняя
выживаемость после такой операции разочаровывающая и, по данным Регистра,
составляет 64%. Однолетняя выживаемость при всех вариантах пересадки легких
составляет 68%, при пересадке одного или двух легких статистика почти идентична
— 69 и 68% соответственно, при более худшем результате в случае пересадки
двух легких одним блоком — 57%.
Дальнейшие перспективы. При пересадке
легких проблема диагностики у потенциального донора решается неудовлетворительно.
Ограниченное число доноров — сильный аргумент в отношении приоритетного
применения операций пересадки одного легкого при наличии соответствующих
показаний; трем пациентам может быть продлена жизнь, если органы, входящие
в комплекс «сердце—легкие», будут пересажаны по отдельности. Не возникает
сомнений в том, что больные с хронической эмфиземой при пересадке одного
Легкого чувствуют себя хорошо. Пересадка двух легких однозначно вызывает
более заметное улучшение функции, при том что летальность в первые 30 дней
после пересадки сопоставима с таковой после пересадки одного легкого, а
кроме того, позволяет избегать вентиляционно-перфузионных нарушений, встречающихся
при пересадке одного легкого. Пересадка комплекса «сердце—легкие» продолжает
рассматриваться как резерв у больных с не подлежащей коррекции патологией
сердца.
ПОЧКИ
Технические представления необходимые для
выполнения пересадки почек, сложились к началу века, когда была разработана
техника сосудистого шва. Пересадка почек сегодня является методом выбора
для лечения многих больных с почечной недостаточностью, хотя гемодиализ
и перитонеальный диализ служат адекватной заменой этой; операции
для большинства пациентов.
Показания и противопоказания.
В принципе необратимая почечная недостаточность — единственное показание
для пересадки почек у больных, не имеющих нарушений оттока мочи, активной
инфекции, тяжелых нарушений трофического статуса или метастатического опухолевого
поражения. Сахарный диабет сегодня относится к наиболее частой причине
почечной недостаточности в США: примерно 30% всех пересадок почек производится
по поводу почечной недостаточности, связанной с диабетической нефропатией
при диабете I типа.
Пересадка почек, при ее успешном
осуществлении, сопровождается значительно большим реабилитационным эффектом
у больных с уремией, чем гемодиализ или перитонеальный диализ. Представляется,
что у диабетиков после пересадки почек возникает меньше проблем, чем при
диализе. Большинство пациентов, перенесших пересадку почек, даже если она
оказалась и неудачной, предпочитают жизнь с пересаженными почками жизни
на хроническом диализе.
В почечном трансплантате
могут возникать рецидивы нескольких заболеваний, однако эти заболевания
являются лишь относительным противопоказанием. Среди них — фокальный гломерулосклероз,
гемолитико-уреми-ческий синдром, мембранозно-пролиферативный гломерулонефрит
с электронно-плотными депозитами и диабетическая нефропатия. Ряд заболеваний
с нарушением обмена веществ (подагра, оксалоз, цистиноз, гиперок-салурия,
нефрокальциноз и амилоидоз) играют незначительную роль, за исключением
накопления в почках патологических депозитов, связанных с почечной недостаточностью.
Пересадка почек может быть успешной при большинстве этих заболеваний, хотя
в пересаженной почке • могут развиваться явления оксалоза.
Подготовка к пересадке.
Должны быть обследованы мочевыводящие пути на предмет отсутствия препятствий
для оттока мочи и отсутствия уре-теровезикального рефлюкса. Обычно для
этого бывает достаточно выполнить цистоуретерографию во время мочеиспускания.
Тканевое типирование и
подбор донора. Из-за ограниченного количества донорских почек многие
центры не используют рутинного подбора по HLA трупных донорских почек.
В дополнение к подбору по HLA важно определить, имеются ли в организме
потенциального реципиента антитела к донорской ткани. Больные, которые
были когда-то сенсибилизированы при переливании им крови, беременности
или ранее производившейся трансплантации, могут быть выявлены путем постановки
реакции их сыворотки с набором нормальных лейкоцитов с известными HLA-свойствами.
Поскольку в крови у многих
больных еще до пересадки есть антитела против тканей потенциальной донорской
почки, непосредственно перед пересадкой ставится проба на наличие в сыворотке
больного антител против донорских лейкоцитов. Если потом окажется, что
такие предсуществовавшие антитела имеются, часто развивается немедленная
(сверхострая) или ускоренная реакция отторжения трансплантата. п
Отбор и обследование доноров из числа
живых людей. С точки зрения реципиента в целом предпочтительнее, чтобы
донором был кровный родственник. Даже без антигенного подбора почки от
доноров, являющихся родными братьями, сестрами или родителями реципиента,
выжидают и функционируют после пересадки лучше и дольше, чем тщательно
подобранные трупные почки. Поскольку генетически определяемая экапреесия
антигенов гистосовместимости определяется в одном (комплексном) локусе,
всегда будет одно главное аллельное различие между родителем и ребенком.
В то время как одна четверть братьев и сестер бущ идентичной, половина
будет иметь различие по одному гаплотипу, а одна четверть будет иметь различие
по обоим гаплотипам. Тканевое типирова| ние обычно способно идентифицировать
таких братьев или сестер (при их существовании), которые имеют одинаковый
набор всех серологически определяемых антигенов основного комплекса гистосовместимости.
Такие трансплантаты от братьев или сестер имеют более чем 95% шансов на
длительное функционирование.
Основные антигены, определяющие принадлежность
человека к определенной группе крови (А, В, 0), относятся к сильным трансплантационным
антигенам. Хотя был выполнен ряд успешных аллотрансплантаций, несмотря
на групповое антигенное различие донора и реципиента, в целом неразумно
пересаживать реципиенту почку от донора с другой группой крови. В клинической
трансплантологии применяется то же правило, что и при переливании крови,
т. е. лица с группой крови А, В являются универсальными реципиентами, а
с группой 0 — универсальными донорами. Если приходится сталкиваться с такими
групповыми барьерами, может развиваться наиболее сильный тип сверхострой
реакции отторжения трансплантата.
Этические проблемы. Существует практика
обязательного информирования реципиента о риске и пользе получения почки
от родственника. Риск для жизни совершенно здорового в других отношениях
реципиента составляет 0,05%. Долговременный риск по статистике равен тому,
которому человек подвергается, проезжая за рулем в качестве водителя автомобиля
каждый рабочий день 29 км. С другой стороны, установлено, что жизнь с одной
почкой не сопровождается какими-либо отдаленными неблагоприятными последствиями.
Подбор трупных донорских почек. В
идеале человек, из трупа которого будут изъяты для пересадки почки, должен
быть: 1) достаточно молодым, 2) в течение ближайшего перед смертью периода
иметь нормальную температуру тела, 3) не страдать заразным инфекционным
заболеванием или злокачественной опухолью и 4) перед смертью в госпитале
он должен быть обследован в течение нескольких часов, во время которых
будет определена группа крови, проведены тканевое антигенное типирование
и исследование мочевыделительной функции. При наличии этих идеальных условий
почки для трансплантации могут быть удалены за считанные минуты, чтобы
свести до минимума время теплой ишемий. Часто, однако, бы-ваея необходимо
идти на компромисс по отношению к упомянутым идеальным принципам. Возраст
донора не играет решающей роли, хотя почки, полученные от маленьких детей,
выживают в организме реципиента хуже. Донорские почки, будучи еще в организме
донора, могут переносить длительный шок и анурию, которые могут иметь место
перед смертью у донора, но время теплой ишемии — т. е. между с смертью
и забором почек — не должно превышать одного часа.
Возможен забор почек в момент смерти и
хранение их в ледяном растворе более 48 ч, пока не будут подготовлены реципиенты.
В настоящее время почки могут сохраняться путем гипотермической перфузии
более 48 ч. Использование для этих целей специальных аппаратов увеличило
доступность для пересадки трупных почек, поскольку.при этом они могут транспортироваться
на дальние расстояния.
Критерии смерти головного мозга. Первая
проблема — установление факта наступления смерти. Поскольку заключение
о смерти делается на основании клинических признаков врачом в интересах
больного (потенциального донора), оно должно основываться в первую очередь
на клинических признаках необратимых изменений со стороны ствола головного
мозга: фиксированные расширенные зрачки, отсутствие рефлексов и ответов
на внешние раздражители, невозможность самостоятельного поддержания жизненно
важных функций, таких как дыхание, сердечные сокращения и артериальное
давление, без искусственного поддержания этих функций. Заключение о смерти
мозга должно приниматься врачами, никак не связанными с потенциальным реципиентом.
Подготовка операции. У большинства
пациентов нет необходимости в удалении собственных почек перед трансплантацией:
Во время подготовки к трансплантации путем скрупулезного обследования у
реципиента должно быть исключено наличие сепсиса из любого источника. Частыми
источниками сепсиса служат: 1) гемодиализные катетеры, если они имеются,
2) мочевой пузырь у больных с предсуществовавшей инфекцией мочевыводящих
путей, 3) кожа при уремическом дерматите и 4) кариозные зубы. Мочевой пузырь
у больных с анурией часто инфицирован и поэтому должен быть промыт соответствующим
количеством антимикробных веществ.
Непосредственно перед трансплантацией диализ
должен проводиться часто и интенсивно. У реципиентов, которым будут пересажены
почки из трупа, времени для подготовки к трансплантации мало.
Трансплантация. Оперативная техника
при пересадке почек стала стандартной. Для подхода к подвздошным сосудам
используется ретро-перитонеальный доступ, и создается анастомоз между почечными
и подвздошными сосудами. После наложения анастомозов не должно быть дефицита
объема циркулирующей крови. Гиповолемия неблагоприятно влияет на быстрое
возобновление функции почечного трансплантата. Моча обычно появляется после
завершения наложения сосудистых анастомозов; мащштол и фуросемид могут.быть
полезными в ускорении получения мочи, что служит хорошим признаком отсутствия
каких-либо серьезных технических недостатков.
Посттрансплантационное лечение. Лечение
больных с пересаженными почками в раннем посттрансплантационном периоде
существенно не отличается от лечения других с больных в постоперационном
периоде. Мочевой катетер оставляется в мочевом пузыре, который не промыварщя;
пока не возникнет подозрения, что он закупорился свертками крови. Ди урез
измеряется каждый час. Объем мочи должен быть восполнен:ч!ййй рехкратным
количеством жидкости. Обычный раствор для возмещения состоит наполовину
из нормального физраствора с 5% декстрозы и водаг с 10 ммоль/л бикарбоната
натрия. Больные сахарным диабетом должйы получать постоянную внутривенную
инфузию инсулина, чтобы поддерайй вать содержание глюкозы в крови на уровне
легкой гипергликемии (1,5*2 г/л). ;
Диурез в раннем послеоперационном периоде
может быть повышен отчасти из-за нарушения функции канальцевого эпителия,
но в первую очередь из-за состояния гипергидратации организма, даже после
хорошего диализа.
Определение содержания в крови азота мочевины,
сывороточного креатинина, его клиренса крайне важно для оценки суточной
функции почек. Периодически необходимо исследовать количество лейкоцитов
и тромбоцитов в крови для оценки состояния кроветворения в ходе им-муносупрессии.
Изредка в качестве осложнений возникают гипергликемия и гиперкальциемия,
поэтому время от времени следует оценивать уровень глюкозы и кальция в
крови. Пациенты с сахарным диабетом нуждаются в более частом определении
уровня глюкозы и корректировке доз инсулина.
Профилактическая иммуносупрессия. Стандартная
иммуносупрес-сия сегодня состоит в применении циклоспорина, азатиоприна
и преднизо-на. Из-за нефротоксических свойств циклоспорина антилимфоцитарные
глобулины (АЛГ) или азатиоприн, или оба вместе используются до тех пор,
пока функция почки не приблизится к нормальной. Когда эта функция стабилизируется,
АЛГ.отменяется, а циклоспорин назначается. В большинстве, центров в настоящее
время сочетание этих четырех препаратов применяется у каждого больного
индивидуально. Комплексная терапия препаратами разнонаправленного действия
позволяет достичь максимальной иммуносу-прессии при минимальных побочных
эффектах, сопровождающих применение каждого из препаратов в отдельности
в высоких концентрациях. При эпизодах отторжения применяют более высокие
дозы преднизона или ме-тилпреднизона. В большинстве центров применение
моноклональных анти-лимфоцитарных антител; используется для борьбы с реакцией
отторжения в случаях резистентности к стероидам.
Осложнения. Почечная недостаточность.
Недостаточность функции почки лучше всего оценивается в связи с временем,
прошедшим
после ее пересадки. Почка может: 1) вообще
не начать функционировать, 2) начать функционировать с запозданием, 3)
перестать функционировать через короткое или продолжительное время, 4)
постепенно утрачивать свою функцию в течение месяцев или лет. В каждом
случае в диагностическом плане следует думать о: 1) ишемическом повреждении
почки,
2) отторжении почки за счет реакции, направленной
против ее антигенов гистосовместимости, 3) технических осложнениях и 4)
развитии болезненного поражения почки — нового заболевания или рецидива
ранее существовавшего.
Ранняя анурия и олигурия. Ранняя
анурия и олигурия представляют основную диагностическую проблему. Их возможными
причинами могут быть: 1) гиповолемия, 2) тромбоз почечных артерии или вены
3) сверхострая реакция отторжения, 4)
ишемическоё повреждение почки,
5) сдавление почки (гематомой, отечной
жидкостью или лимфой),
6) обструкция мочевыводящих путей.
Если олигурия не связана с закупоркой катетера,
следует исключить кровотечение и гиповолемию в сочетании со сдавлением
и смещением почки гематомой. Если развивается анурия или тяжелая олигурия,
вос-стан&вление объема циркулирующей крови редко способствует восстановлению
функции почек, даже если используют фуросемид или Другие диуретики. Многим
пациентам требуется реоперация для остановки кровотечения.
Технические осложнения. Тромбоз
анастомоза почечной артерии встречается редко. Гораздо чаще- возникает
парциальная обструкция в результате перекрута или смещения сосудов, что
требует немедленного устранения. Внутрилоханочное кровотечение относится
к серьезным осложнениям, которое может вести к инфекции. Оно требует неотложной
реоперации.
Сверхострая реакция отторжения. Сверхострая
реакция отторжения почечного трансплантата почти всегда протекает с участием
антител. Классическая сверхострая реакция теперь наблюдается редко, поскольку
лабораторные методы позволяют обнаруживать антитела, направленные против
донорских антигенов гистосовместимости. Изредка возникает гиперактивная
реакция и при отсутствии цитотоксических антител. Действительно, цитотоксические
антитела у больных, ожидающих трансплантацию, периодически то выявляются,
то не выявляются. При классической сверхострой реакции почка не восстанавливает
свой нормальный тургор и здоровый розовый цвет после наложения сосудистых
анастомозов. При гистологическом исследовании нефробиоптата в это время
можно обнаружить лейкоциты в капиллярах клубочков и затем — тромбоз сосудов.
Острый некроз эпителия канальцев. Если
все другие причины недостаточности функции почки в раннем посттрансплантационном
периоде исключены, следует думать об остром некрозе эпителия канальцев
(ОНЭК). Термин «острый некроз эпителия канальцев» в клинической практике
используют для обозначения изменений почек, функция которых ухудшена из-за
ишемии или ряда других причин. Если в этом,.случае выполняется нефробиопсия,
чаще всего выявляется только гидропическая дистрофия эпителия.
ОНЭК встречается в пересаженной трупной
почке, когда у донижи в течение длительного периода времени отмечались
стресс или гипотензия. Другой причиной ОНЭК может быть длительная теплая
ишемия, предшествовавшая трансплантации. Почки с временным интервалом тёплой
ишемии более 1 ч не должны использоваться для пересадки, поскольку функция
их редко восстанавливается до нормальной. Холодная ищемия переносится
гораздо лучше и хранение трансплантата до 48 ч дает ня хорошие результаты.
Лечение пациентов с ОНЭК осуществляется
просто. Мочеотделения восстанавливается почти во всех случаях через 2 или
3 нед, но бывают случаи анурии длительностью до 6 нед, заканчивающиеся
полным восстали новлением функции.
Отторжение трансплантата. У большинства
пациентов в течение первых 3-4 мес после пересадки почки возникает не менее
одного эпизода острого отторжения. Клинически реакция отторжения редко
протекает по принципу «все или ничего», и первый эпизод редко прогрессирует
до полного разрушения трансплантата. Функциональные изменения, связанные
с отторжением, в значительной мере обратимы. Поэтому распознавание и лечение
начала реакции отторжения до развития тяжелого" поражения почки крайне
важно. Обычно реакция отторжения подавляется увеличением дозы преднизона
и местным облучением.
Клиническая картина реакции отторжения
может быть чрезвычайно похожа на ряд других: подтекание из мочеточника
или его обструкция, кровотечение с последующим ОНЭК, инфекция, стеноз или
перекрут почечной артерии или вены. Классическая реакция отторжения почки
характеризуется олигурией, увеличением и болезненностью трансплантата при
пальпации, слабостью, лихорадкой, лейкоцитозом, гипертонией, увеличением
массы тела и периферическими отеками. В анализах мочи выявляются лимфоцитурия,
слепки эритроцитов, белок, фрагменты иммуноглобулина и фибрина, Отмечается
снижение выделения натрия, почечный канальцевый ацидоз и увеличение активности
лактатдегидрогеназы в моче. Уровень азота мочевины в крови, также как и
сывороточного креатинина, повышается. Клиренс креатинина обычно снижен;
на ренограммах отмечается замедление восприятия почкой гиппурана и замедление
экскреции мочи. Эхография может выявить отек почечных сосочков.
В больцишстве учреждений разработана стандартная
схема ведения больных после пересадки почек. Эта схема может быть повторена
до трех раз в течение 2 мес у больных, у которых после развития
реакции отторжения не удается достичь ремиссии.
Результаты. Исходы после трансплантации
почек превосходны (рис. 10.4).
Рис. 10.4. А — выживаемость
(%) пересаженных трупных почек в UNOS в 1987-1990 гг. по сравнению со второй
и третьей пересадками. Б — выживаемость почечных трансплантатов,
полученных от живых доноров, а — идентичные по HLA братья и сестры (466),
о — дети (15.1), в — братья (сестры) со сходным гаплотипом (385),
г — родители (1230), д — супруги (43). В — эффект
в случае игнорирования при подборе HLA А, В, Си DR на выживаемость пересаженной
первичной трупной почки при первой ее пересадке. Цифры означают
количество случаев игнорирования, п — количество больных. (По: Terasaki
P. I. Clinical transplants, 1990. — Los Angeles, UCLA Tissue Typing
Laboratory, 1991. — P. 2, 8, 590.)
Трансплантация у детей. Малый Калибр
сосудов и активное общественное поведение детей делает их лечение с помощью
гемодиали-за крайне затруднительным. Принято считать, что длительная иммунбсу-прессия
также вмешивается в темпы развития ребенка. Хронический гемодиализ редко
дает удовлетворительные результаты, а родители почти всегда готовы в качестве
донора, пожертвовать свою почку. Большенство детей с пересаженной почкой)-растет
чуть медленнее нормы; в итоге их рост оказывается значительно выше, чем
при хроническом гемодиализе.
Повторные трансплантации. Рядом
исследований показано, что вторая и третья пересадки почки оказываются
менее успешными чем первая. Особенно это справедливо, если трансплантат
отторгся вскоре после пересадки. Отторжение одного трансплантата может
сенсибйлйи-ровать пациента к ряду более слабых антигенов гистосовместимос^
которые не могут быть легко определены при антигенном подборе.
Методы
сохранения органов для трансплантации
Когда орган удаляется, он лишается нормальной
оксигенации.!Два основных подхода к сохранению органов могут
быть обозначены как метод угнетения метаболизма и метод поддержания метаболизма.
При метаболическом угнетении производится
попытка предотвратить тяжелое повреждение тканей за счет торможения нормальных
катаболи-ческих процессов. В настоящее время это наилучшим образом достигается
с помощью гипотермии, которая защищает орган за счет замедления метаболических
процессов и снижения потребности в кислороде. В настоящее время применяют
две методики охлаждения: 1) простое охлаждение почки путем погружения ее
или орошения холодным раствором и 2) перфузионное охлаждение, которое обеспечивает
более длительный период хранения.
При метаболической поддержке, втором
подходе к сохранению органа, пытаются поддержать метаболическую активность
на уровне, максимально приближенном к физиологическому. Обычно это достигается
перфузией органа in vitro жидкостью с тщательно подобранным составом, хотя
может производиться и попытка оксигенации. На практике метаболическая поддержка
всегда комбинируется с перфузионным охлаждением. В лучших системах в настоящее
время используют пульсирующий насос и специальную емкость, заполненную
гомологичной плазмой, пропущенной через мембранный оксигенатор. Не все
органы могут перфузироваться достаточно хорошо при таком подходе. Необходимо
сделать несколько предупреждений. Период времени между прекращением тока
крови через орган и его помещением в новую среду (время теплой ишемии)
является критическим для сохранения почки. Температура также важна. В новейшие
перфузионные системы входит приспособление для гипотермии, позволяющее
уменьшить потребность органа в кислороде и питательных веществах. Оксигенация
также играет важную роль. Кислород растворяется в водном растворе лучше
при более низких температурах; мембранный оксигенатор встроен в систему.
Другим фактором является пульсация. Перфузия
сопровождается меньшим повреждением органа, когда жидкость в его сосуды
подается в пульсирующем режиме, обычно при нормальной температуре. Необходимость
пульсирующего режима подачи перфузата при гипотермии документально точно
не подтверждена. Несомненное значение имеет состав перфузата. Цельная плазма,
вероятно, наиболее физиологична в качестве перфузата и содержит наибольшее
количество питательных веществ, в том числе жирные кислоты, которые могут
понадобиться для обеспечения метаболизма органа. Применение разработанного
недавно для перфузии состава UW (University of Wisconsin) сопровождается
улучшением результатов пересадки трупных органов, в том числе печени и
почек, и более длительным временем допустимой ишемии органа.
Имеются данные о том, что трансплантабельность
и выживаемость органа после трансплантации в значительной степени зависят
от адекватной перфузии во время хранения его до пересадки.
Другим важным фактором, вызывающим нарушения
кровотока и пересаженном органе, является блокада микрососудов. Описано
множество причин такой блокады, в том числе образование пузырьков в перфузионной
системе, преципитация фибрина, агглютинация эритроцитов, адгезия тромбоцитов
и лейкоцитов к эндотелиоцитам, повреждение клеток в результате технически
несовершенной перфузии, формирование кристаллов и даже агглютинация бактерий.
В качестве материала, образующего агрегаты, описаны липопротеины. К счастью,
эти вещества могут быть легко удалены из плазмы путем замораживания, вызывающего
флокуляцию (выпадение хлопьев) липопротеинов, которые в дальнейшем могут
быть удалены путем фильтрации и/или ультрацентрифугирования. |
